ALCANOS
Un alcano es un hidrocarburo: un compuesto químico formado a partir de la combinación de carbono e hidrógeno. En este caso, se trata de un hidrocarburo saturado, ya que sus enlaces covalentes son sencillos.
Algunos datos de los alcanos pueden ser que -La fórmula que les define es CnH2n+2. En este caso, hay que exponer que la n corresponde al número de carbonos que tiene.
- A la hora de nombrar a los alcanos se utiliza el sufijo "ano" y un prefijo dependiendo de sus diferentes tipos, por ejemplo "met", "but", "et", "prop".
-A la hora de analizar, trabajar y utilizar alcanos cobran especial
importancia y valor desde lo que es su combustión hasta los conocidos
diagramas de energía potencial.
En general se dice que los alcanos son alifáticos debido a que la estructura de sus moléculas supone una cadena abierta.
En general se dice que los alcanos son alifáticos debido a que la estructura de sus moléculas supone una cadena abierta.
Propiedades:
De los alcanos se puede decir que son insolubles en el agua.
-El principal uso que se les suele dar es como combustibles.Porque, de manera incuestionable, liberan una gran cantidad de calor.
-Por regla general, los alcanos se dividen en cuatro grupos diferenciados: cíclicos, lineales, policíclicos y ramificados.
-Sus puntos de ebullición y también de fusión son bajos.
-No son rígidos.
-El principal uso que se les suele dar es como combustibles.Porque, de manera incuestionable, liberan una gran cantidad de calor.
-Por regla general, los alcanos se dividen en cuatro grupos diferenciados: cíclicos, lineales, policíclicos y ramificados.
-Sus puntos de ebullición y también de fusión son bajos.
-No son rígidos.
 Obtención:
Obtención:
En nuestro planeta, es posible encontrar alcanos en el petróleo, el gas natural y el biogás, entre otras fuentes. También se halla en el estómago de las vacas como gas metano.
Usos:
Es posible emplear ciertos alcanos para producir electricidad o como combustible para calefaccionar e impulsar motores. Los alcanos además sirven para obtener aceites. El uso de los alcanos debe controlarse ya que se trata de un compuesto que, al mezclarse con el aire, puede explotar.
ALQUENOS
Los alquenos solían ser conocidos como olefinas, ya que
los compuestos de mayor simpleza generan óleos al establecer una
reacción con un halógeno. Los alquenos, por otra parte, cuentan con
características físicas diferentes respecto a los alcanos debido a que el doble enlace de carbono cambia las propiedades vinculadas a la acidez y a la polaridad.
Reacción química: se trata de un fenómeno que también se conoce con el nombre de cambio químico
y que consiste en un proceso termodinámico (ciertas magnitudes
atraviesan una evolución) en el cual una sustancia o más sufren una
transformación que cambia sus enlaces y su estructura molecular para dar
lugar a nuevas sustancias, las cuales se denominan productos.
 Benceno:
Benceno:
El benceno es una molécula aromática y muy estable, mucho más que un
alqueno, por tanto su reactividad es mucho menor que la que podría tener
un alqueno suelto en una cadena de hidrocarburos. Por otro lado la
resonancia de los electrones en los enlaces pi del benceno favorecen
otro tipo de reacciones en la que se necesite estabilizar electrones
como puedan ser reacciones electrofilas
Nomenclatura:
-Se elige como cadena principal la de mayor longitud que contenga el
doble enlace.
- La numeración comienza en el extremo que otorga al doble
enlace el menor localizador.
-El nombre de los sustituyentes precede
al de la cadena principal y se acompaña de un localizador que indica su
posición en la molécula.
- La molécula se numera de modo que el doble enlace tome el localizador más bajo.
- La molécula se numera de modo que el doble enlace tome el localizador más bajo.
-Cuando hay varios sustituyentes se ordenan alfabéticamente y se acompañan
-Cuando el doble enlace está a la misma distancia de ambos extremos, se
numera para que los sustituyentes tomen los menores localizadores.
-En compuestos cíclicos resulta innecesario indicar la posición del doble
enlace, puesto que siempre se encuentra entre las posiciones 1 y 2.
Usos y obtención:
Entre los alquenos, podemos mencionar al etileno, que se encuentra en las plantas. Cuando al etileno se le añade agua, es posible obtener etanol.
Por otra parte, a través de un catalizador metálico, se puede llevar a
cabo una reacción entre el etileno y el hidrógeno molecular para
conseguir etano.
El isobutileno es otro alqueno que se utiliza en el ámbito de la industria.
De estructura ramificada, el isobutileno es un gas que carece de color y
que es inflamable cuando se halla en una condición normal de
temperatura y de presión.
AlQUINOS
Los alquinos son hidrocarburos alifáticos con al menos un Triple enlace (dos enlaces π pi y uno Σ sigma) -C≡C- entre dos átomos de carbono. Se trata de compuestos metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-
Propiedades
Físicas:
1) Son insolubles en agua, pero bastante solubles en disolventes orgánicos usuales y de baja polaridad: éter, benceno, tetracloruro de carbono.
2) Son menos densos que el agua y sus puntos de ebullición muestran el aumento usual con el incremento del número de carbonos y el efecto habitual de ramificación de las cadenas.
3) Los puntos de ebullición son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado.
Químicas:
1) Son insolubles en agua, pero bastante solubles en disolventes orgánicos usuales y de baja polaridad: éter, benceno, tetracloruro de carbono.
2) Son menos densos que el agua y sus puntos de ebullición muestran el aumento usual con el incremento del número de carbonos y el efecto habitual de ramificación de las cadenas.
3) Los puntos de ebullición son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado.
Químicas:
Las reacciones más frecuentes son las de adicción: de hidrógeno, halógeno, agua, etc. En estas reacciones se rompe el triple enlace y se forman enlaces de menor polaridad: dobles o sencillos.

Obtención
Existen dos procedimientos para la obtención de
alquinos:
- Deshidrohalogenación de halogenuros de alquilo vecinales.
- Deshidrohalogenación de halogenuros de alquilo geminales (gem-dihalogenuros).

Usos
La mayor parte de los alquinos se fabrica en
forma de acetileno. A su vez, una buena parte del acetileno se utiliza
como combustible en la soldadura a gas debido a las elevadas
temperaturas alcanzadas. por ejemplo en la síntesis del PVC (adición de
HCl) de caucho artificial etc.
HALOGENOS
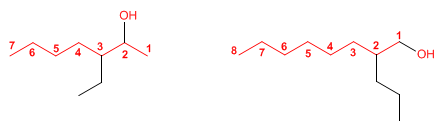
Los halogenuros de alquilo, haluros de alquilo, halogenoalcanos o haloalcanos, son compuestos químicos en los que uno o más de los átomos de hidrógeno de un alcano han sido reemplazados por átomos de halógeno (usualmente uno o más de flúor, cloro, bromo o yodo). En un halógenoalcano primario (1 °), el carbono que lleva el átomo de halógeno está unido solamente a otro grupo alquilo. En la figura 1 se dan ejemplos de haloalcanos primarios.En un halógenoalcano secundario (2º), el carbono con el halógeno unido, está unido directamente a otros dos grupos alquilo, que pueden ser iguales o diferentes. En la figura 2 se ilustran ejemplos de haloalcanos secundarios. En un halógenoalcano terciario (3º), el átomo de carbono que contiene el halógeno está unido directamente a tres grupos alquilo, que pueden ser cualquier combinación de los mismos o diferentes.
Nomenclatura
Según la IUPAC se deben seguir tres normas para nombrar a los halogenuros de alquilo: • Se numera la cadena madre para dar al sustituyente encontrado primero el número más bajo, ya sea halógeno o un grupo alquilo. • Se indican los sustituyentes de halógeno por los prefijos flúor, cloro, bromo y yodo y enumerarlos en orden alfabético con otros sustituyentes. • Se localiza cada halógeno en la cadena principal dándole un número que precede al nombre del halógeno.Usos
Los halogenuros de alquilo tienen diversos usos, entre ellos encontramos extintores de incendios, propelentes y disolventes. Los haloalcanos reaccionan con muchas sustancias que conducen a una amplia gama de diferentes productos orgánicos por lo tanto son útiles en el laboratorio como intermediarios en la fabricación de otros productos químicos orgánicos. Algunos haloalcanos tienen efectos negativos sobre el medio ambiente, como el agotamiento del ozono. La familia más conocida dentro de este grupo son los clorofluorocarbonos, o CFCs para abreviar.ALCOHOLES
Los alcoholes son compuesto orgánicos que contienen el grupo hidroxilo (-OH). El metanol es el alcohol más sencillo, se obtiene por reducción del monóxido de carbono con hidrógeno.
El metanol es un líquido incoloro, su punto de ebullición es 65ºC, miscible en agua en todas las proporciones y venenoso (35 ml pueden matar una persona)
La mitad del metanol producido se oxida a metanal (formaldehído), material de partida para la fabricación de resinas y plásticos.
La mitad del metanol producido se oxida a metanal (formaldehído), material de partida para la fabricación de resinas y plásticos.
El etanol se obtiene por fermentación de materia vegetal, obteniéndose una concentración máxima de 15% en etanol. Por destilación se puede aumentar esta concentración hasta el 98%.
También se puede obtener etanol por hidratación del etileno (eteno) que se obtiene a partir del petróleo.
También se puede obtener etanol por hidratación del etileno (eteno) que se obtiene a partir del petróleo.
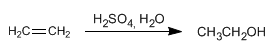
El etanol es un líquido incoloro, miscible en agua en todas proporciones, con punto de ebullición de 78ºC. Es fácilmente metabolizado por nuestros organismos, aunque su abuso causa alcoholismo.
Nomenclatura
Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

Regla 2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
Regla 3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
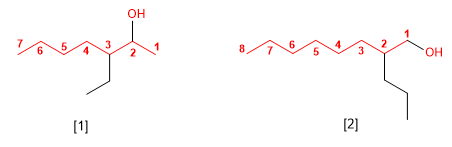
Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
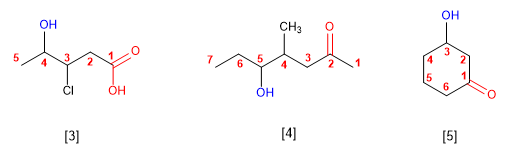
Regla 5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
Acidez y basicidad.
Los alcoholes son especies anfóteras (anfipróticas), pueden actuar como ácidos o bases. En disolución acuosa se establece un equilibrio entre el alcohol, el agua y sus bases conjugadas.
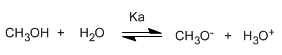
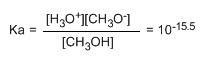
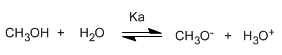
Escribiendo la constante del equilibrio (Ka)
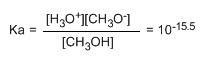
El pequeño valor de la constante nos indica que el equilibrio está totalmente desplazado a la izquierda. El logaritmo cambiado de signo de la constante de equilibrio nos da el pKa del metanol, parámetro que indica el grado de acidez de un compuesto orgánico.
pKa = - log ka = 15.5
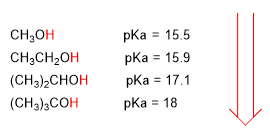
El aumento del pKa supone una disminución de la acidez. Asi, el metanol con un pka de 15.5 es ligeramente más ácido que el etanol con pka de 15.9.
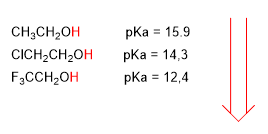
El pKa de los alcoholes se ve influenciado por algunos factores como son el tamaño de la cadena carbonada y los grupos electronegativos
Al aumentar el tamaño de la cadena carbonada el alcohol se vuelve menos ácido.

Los grupos electronegativos (halógenos) aumentan la acidez de los alcoholes (bajan el pKa)

Síntesis de alcoholes a partir de haloalcanos.
Los alcoholes se pueden obtener a partir de haloalcanos mediante reacciones SN2 y SN1
Síntesis de alcoholes mediante SN2
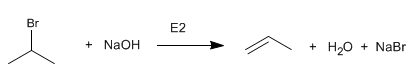
Los haloalcanos primarios reaccionan con hidróxido de sodio para formar alcoholes. Haloalcanos secundarios y terciarios eliminan para formar alquenos.
El bromuro de isopropilo (sustrato secundario) elimina al reaccionar con el ión hidróxido.
Síntesis de alcoholes mediante SN1
Los sustratos secundarios y terciarios reaccionan con agua mediante mecanismo SN1 para formar alcoholes.
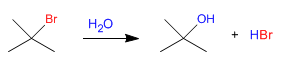
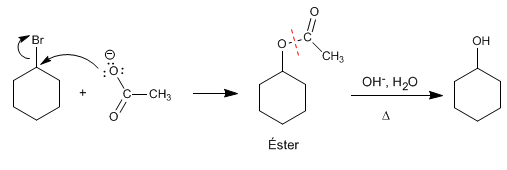
Hidrólisis de ésteres
Es un método interesante para preparar alcoholes a partir de haloalcanos secundarios. El haloalcano se convierte en éster por reacción con acetato de sodio, para después hidrolizarse en medio ácido o básico, obteniéndose el alcohol.
Síntesis de alcoholes por reducción de carbonilos.
Tanto el borohidruro de sodio (NaBH4) como el hidruro de litio y aluminio (LiAlH4) reducen aldehídos y cetonas a alcoholes.
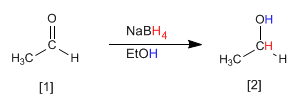
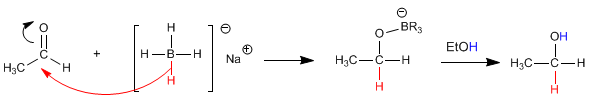
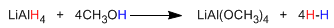

El etanal [1] se transforma por reducción con el borohidruro de sodio en etanol [2].
El mecanismo transcurre por ataque del hidruro procedente del reductor sobre el carbono carbonilo. En una segunda etapa el disolvente protona el oxígeno del alcóxido.

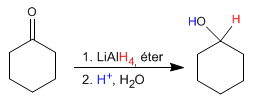
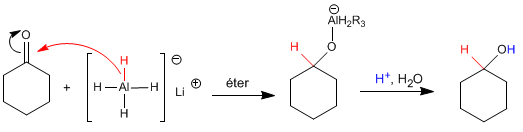
El hidruro de litio y aluminio trabaja en medio éter y transforma aldehídos y cetonas en alcoholes después de una etapa de hidrólisis ácida.

El mecanismo es análogo al del borohidruro de sodio.

El reductor de lítio y aluminio es más reactivo que el de boro, reacciona con el agua y los alcoholes desprendiendo hidrógeno. Por ello, debe disolverse en medios apróticos (éter).
El reductor de boro, menos reactivo, descompone lentamente en medios próticos, lo que permite utilizarlo disuelto en etanol o agua.
Síntesis de alcoholes por hidrogenación de carbonilos
Otro método para preparar alcoholes consiste en la reducción de aldehídos o cetonas a alcoholes. El método más simple es la hidrogenación del doble enlace carbono-oxígeno, utilizando hidrógeno en presencia de un catalizador de platino, paladio, niquel o rutenio.
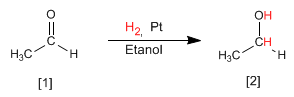
El etanal [1] se transforma por hidrogenación del doble enlace en etanol [2]
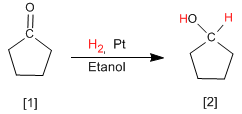
La ciclopentanona [1] se transforma por hidrogenación en ciclopentanol [2]
Síntesis de alcoholes a partir de epoxidos
Los alcoholes se pueden obtener por apertura de epóxidos (oxaciclopropanos). Esta apertura se puede realizar empleando reactivos organometálicos o el reductor de litio y aluminio.
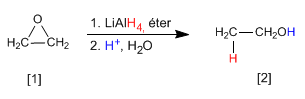
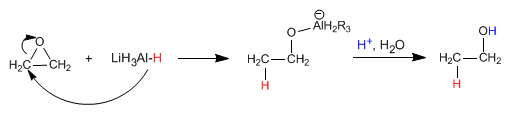
Los reactivos de Grignard (organometálicos de magnesio) y los organolíticos reaccionan con oxaciclopropano para dar un alcohol primario.
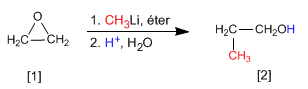
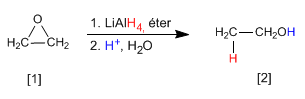
El oxaciclopropano [1] se transforma por reducción con hidruro de litio y aluminio en etanol [2].
El mecanismo el mecanismo de la reacción comienza con el ataque el hidruro procedente del redutor sobre el carbono polarizado positivamente del epóxido, para terminar con la protonación del alcóxido

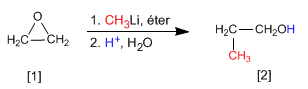
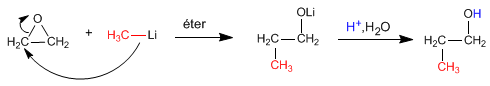
El metillitio ataca al oxaciclopropano [1] para formar propan-1-ol [2]

Oxidación de alcoholes
La oxidación de alcoholes forma compuestos carbonilos. Al oxidar alcoholes primarios se obtienen aldehídos, mientras que la oxidación de alcoholes secundarios forma cetonas.
Oxidación de alcoholes primarios a aldehídos
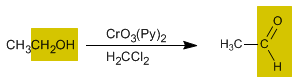
Son Antisépticos y desinfectantes
 Son productos que inhiben el crecimiento de los microorganismos y los destruyen. En el caso de que se utilicen sobre seres vivos, se denominan antisépticos.
Son productos que inhiben el crecimiento de los microorganismos y los destruyen. En el caso de que se utilicen sobre seres vivos, se denominan antisépticos. Existen muchas sustancias que pueden ser usadas para el tratamiento de las heridas, pero sólo se comentarán las más frecuentes.
Existen muchas sustancias que pueden ser usadas para el tratamiento de las heridas, pero sólo se comentarán las más frecuentes. Los más habituales son el alcohol etílico o etanol y el alcohol isopropílico.
Los más habituales son el alcohol etílico o etanol y el alcohol isopropílico. Las concentraciones varían entre el 70 y el 96% en el caso del primero y entre el 70 y el 100% en el segundo.
Las concentraciones varían entre el 70 y el 96% en el caso del primero y entre el 70 y el 100% en el segundo. Aunque sus aplicaciones son idénticas, se suele usar habitualmente el etanol por ser el menos irritante. No debe utilizarse en heridas abiertas, ya que es un producto irritante y favorece la aparición de coágulos, que encierran dentro bacterias vivas que se encuentran aún en la herida.
Aunque sus aplicaciones son idénticas, se suele usar habitualmente el etanol por ser el menos irritante. No debe utilizarse en heridas abiertas, ya que es un producto irritante y favorece la aparición de coágulos, que encierran dentro bacterias vivas que se encuentran aún en la herida.Usos
Se utilizan como productos químicos intermedios y disolventes en las industrias textiles, colorantes, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas, barnices, tintes de secado rápido, anticongelantes, agentes espumigenos y en la flotación de minerales.
Citas
(2015). Alquinos. 14/11/18, Sitio web: https://prezi.com/ivby7thyopbz/usos-y-aplicaciones-de-los-alqunos/
Quimicas.net (2018). "Los Halógenos". Recuperado de:
https://www.quimicas.net/2015/06/los-halogenos.html
https://www.quimicas.net/2015/06/los-halogenos.html
Ponce C,. (2015). Alcoholes usos y aplicaciones. Noviembre 13, 2018, de Prezi Sitio web: https://prezi.com/uw-yxsamn9oj/alcoholes-usos-y-aplicaciones/
Fernandez G. (2017). Alcanos. Noviembre 11, 2018, de Quimica Organica Sitio web: https://www.quimicaorganica.org/alcanos.html
Integrantes
Luis Alberto Hernández Alcocer 15015454
Eva Patricia Montserrat Herrera Reyes 16010688
Andrea Herrera Mendoza 15011789
Jesús Enrique Ayala Arias





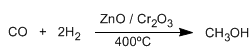
No hay comentarios.:
Publicar un comentario